Ouvrir la version "Familles" de cette fiche
| Pathologie | Leucémie aigue lymphoblastique à chromosome Philadelphie (Ph+) | Statut de l'essai | Ouvert aux inclusions |
| Type de l’étude | Interventionnelle | Phase | III |
| Age | de 0 à 21 ans | Randomisation | OUI |
| Type du traitement | Traitement exclusif (Chimiothérapie, Thérapie ciblée) | Nombre d'inclusions attendues en France | 90 |
| Voie(s) d'administration du traitement | Perfusion intraveineuse et prise orale selon le médicament administré |
| Fin prévisionnelle des inclusions | 2024-09-30 | Date de la dernière mise à jour de la fiche | 2025-04-09 |
| Durée de participation | 6 ans |
| N° EUDRACT | 2017-000705-20 | N° ClinicalTrials.gov | NCT03007147 |
Promoteur international
Université de Milano-Bicocca (Italie)Promoteur Français
CHU de RennesInvestigateur principal
Pr Virginie GandemerCentres
Responsable du centre
Pr Isabelle PELLIER
Service d’Oncologie Pédiatrique
Tél. : 02 41 35 38 63 Fax : 02 41 35 52 91
Assistantes sociales
Célia Fillon
Tél : 02 41 35 49 85
CeFillon@chu-angers.fr
Attaché(e) de Recherche Clinique
Marianne ROUMY
02 41 35 63 85
marianne.roumy@chu-angers.fr
Responsable du centre
Dr Antoine Gourmel
Secrétariat :
Tél. : 03 22 08 76 44 Fax : 03 22 08 96 79
Assistantes sociales
Madame
Emilie Poillion
Poillion.Emilie@chu-amiens.fr
Attaché(e) de Recherche Clinique
Alicia PLAYE
03 22 08 76 49
playe.alicia@chu-amiens.fr
Responsable du centre
Pr Justyna KANOLD
Centre Régional de Cancérologie et de Thérapie Cellulaire Pédiatrique
Tél : 04 73 75 00 09
Assistantes sociales
Charlotte MORTIER
Tel : 04 73 75 03 00 (poste 61441) / Mail : cmortier@chu-clermontferrand.fr
Attaché(e) de Recherche Clinique
Aurélie CHAUSSET
Tel : 04 73 75 51 77 / Mail : achausset@chu-clermontferrand.fr
Responsable du centre
Dr Claire briandet
Service d’Oncologie Hématologie Pédiatrique
Tél : 03 80 29 34 14 / Mail : nadira.mareghnia@chu-dijon.fr
Assistantes sociales
Chloé ARNOULT
Tel : 03 80 29 33 09 / Mail : chloe.arnoult@chu-dijon.fr
Attaché(e) de Recherche Clinique
Frédérique DEBOMY
Tel : 03 80 29 50 78 / Mail : frederique.debomy@chu-dijon.fr
Responsable du centre
Dr Corinne Armari Alla
Tél : 04 76 76 69 95
Assistantes sociales
Valérie GOITRE
Tel : 04 76 76 79 39 / Mail : VGoitre@chu-grenoble.fr
Attaché(e) de Recherche Clinique
Sandrine BILLET
Tel : 04 76 76 65 61 / Mail : SBillet@chu-grenoble.fr
Responsable du centre
Dr Perrine MAREC-BERARD
Institut d'Hématologie et d'Oncologie Pédiatrique
Tél. : 04 78 78 26 42
Assistantes sociales
Maryline SEVE
Tel : 04 69 16 65 58 / Mail : maryline.seve@chu-lyon.fr
Attaché(e) de Recherche Clinique
Cécile GIRAUD
Tel : 04 69 16 65 61 / Mail : cecile.giraud@lyon.unicancer.fr
Responsable du centre
Dr Marie-Pierre CASTEX
Unité d'Hémato-oncologie Pédiatrique
Tel : 05 34 55 86 10
Assistantes sociales
Mélanie LAUTRE
Tel : 05 34 55 87 12 / Mail : lautre.m@chu-toulouse.fr
Pauline BOHLAY
Tel : 05 34 55 85 93 / Mail : bohlay.p@chu-toulouse.fr
Attaché(e) de Recherche Clinique
Gwennaëlle LE ROY
Tel : 05 67 77 13 94 / Mail : leroy.g@chu-toulouse.fr
Responsable du centre
Dr Julien Lejeune
Service d’Onco-Hématologie Pédiatrique
Tél : 02 47 47 47 51
Assistantes sociales
Ismeri LEBLANC
Tel : 02 34 38 94 48 / Mail : i.leblanc@chu-tours.fr
Attaché(e) de Recherche Clinique
Christine COLOMBAT
Tel : 02 47 47 47 47 poste 76793 / Mail : c.colombat@chu-tours.fr
Descriptif de l'étude
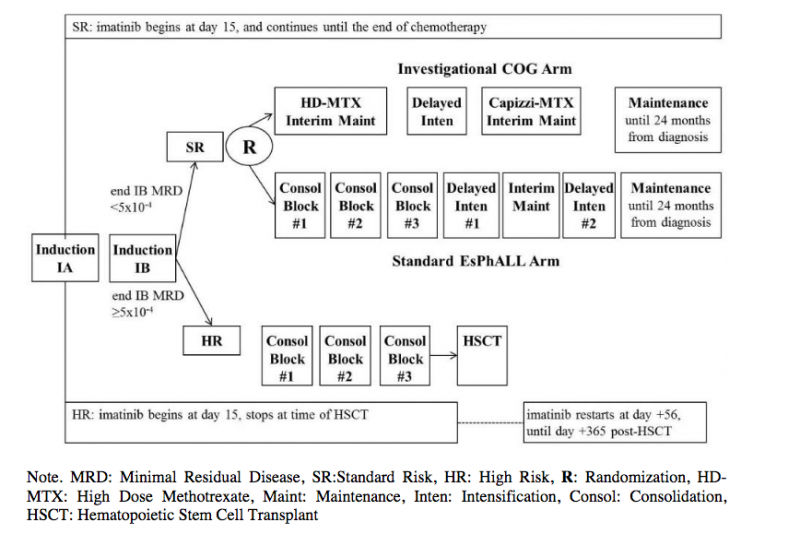
EsPhALL 2017-02 est un essai collaboratif international conjoint COG et EsPhALL dont l'objectif principal est de réduire la morbidité et la mortalité liées au traitement sans impact négatif sur l'efficacité chez les patients Ph+ ALL de Risque Standard (SR), soit ceux ayant un faible niveau de maladie résiduelle (MRD) à la 10-12ème semaine de traitement.
Les patients Ph+ ALL entreront dans l'essai au Jour 15 de l'Induction IA. Un traitement par imatinib (traitement continu quotidien) sera alors ajouté à IA. Après la phase d'induction IB (semaine 10-12), une PCR ciblant les réarrangements des chaînes lourdes des immunoglobulines évaluera la MRD, et les patients seront classés comme SR (MRD<5x10-4) ou de risque élevé (HR; MRD>5x10-4). Au besoin, la cytométrie de flux sera utilisée en recours pour la prise de décision clinique.
Les patients SR, soit environ 80 à 85% des patients pédiatriques Ph+ ALL, seront randomisés pour recevoir l'un des deux schémas de chimiothérapie, sans aucune HSCT: 1) le schéma EsPhALL (bras A) utilisé dans les précédents protocoles EsPhALL; ou 2) un régime de type COG, moins intensif, inspiré de celui administré aux patients HR non Ph+ (bras B). L'imatinib continuera à être administré quotidiennement aux patients des deux bras jusqu'à la fin du traitement (deux ans de traitement). Les survies sans maladie de chaque bras seront comparées (essai de non-infériorité). La toxicité de chaque régime thérapeutique sera directement comparée.
Pour les patients HR (environ 15 à 20% des patients), une HSCT allogénique en CR1 est toujours considérée comme le traitement requis. Les patients HR recevront le schéma standard de chimiothérapie (HSCT proposée après trois blocs de consolidation). Le traitement par imatinib sera repris du 56ème jour au 365ème post-HSCT. Du fait de la variabilité des pratiques d'utilisation des ITK après HSCT et la controverse concernant leur impact sur la toxicité, la maladie du greffon contre l'hôte et la survie sans évènement, nous testerons la faisabilité de ce traitement par imatinib après l'HSCT, et en décrirons le résultat.
Critères d'inclusion
- 1 an < âge au diagnostic ≤ 21ans ;
- LAL Ph+ non traitée antérieurement et documentée par cytogénétique, FISH et/ou RT-PCR
- Eligibilité pour les études prospectives thérapeutiques de 1ère ligne dans les LAL de l’enfant émanant des groupes nationaux
- Induction débutée comprenant de la vincristine, un corticoïde, de la PEG-L-Asparaginase, avec ou sans anthracyclines, et/ou une autre chimiothérapie standard
- Administration de moins de 15 jours d’une multichimiothérapie comptée à partir de la 1ère dose de vincristine
- Administration de moins de 15 jours d’Imatinib
- Statut de performance correspondant à un score ECOG de 0, 1 ou 2
- Fonction hépatique satisfaisante (bilirubine ≤ 2.0 mg/dl)
- Fonction rénale satisfaisante (créatinine dans la limite de la normale pour l’âge et le sexe ou clairance calculée de la créatinine ≥ 70 ml/min/1,73 m2)
- Fonction cardiaque satisfaisante
Critères de non inclusion
- Antécédent de leucémie myéloïde chronique
- LAL secondaire à une première chimiothérapie pour cancer
- Infection systémique active non contrôlée (fongique, bactérienne ou virale), ventilation mécanique ou des symptômes de choc septique nécessitant des amines vasopressines;
- Grossesse ou refus d’utilisation d’une contraception efficace chez une patiente en âge de procréer
- Allaitement
- Trisomie 21 constitutionnelle
- Syndrome du QT long congénital ou antécédent d’arythmie ventriculaire ou de bloc de branche
- Traitement antérieur par Dasatinib ou un autre inhibiteur de BCR-ABL1 autre que l’Imatinib