Ouvrir la version "Familles" de cette fiche
| Pathologie | Sarcomes d’Ewing | Statut de l'essai | Clos |
| Type de l’étude | Interventionnelle | Phase | III |
| Age | > 2 ans et < 50 ans à la date de la 1ère randomisation | Randomisation | OUI |
| Type du traitement | Traitements (adjuvants) combinés, Traitement exclusif (Chimiothérapie) | Nombre d'inclusions attendues en France | 300 |
| Voie(s) d'administration du traitement | Perfusion intraveineuse |
| Fin prévisionnelle des inclusions | 2019-05-03 | Date de la dernière mise à jour de la fiche | 2021-07-22 |
| Durée de participation | La durée du traitement est d’environ un an et demi et le suivi se fera sur une période maximum de 5 ans.
|
| N° EUDRACT | 2012-002107-17 | N° ClinicalTrials.gov | N/A |
Promoteur international
Université de Birmingham, Royaume-Uni
Promoteur Français
Centre Léon Bérard (CLB)Investigateur principal
Dr Perrine MAREC BERARD (France)
Dr Bernadette Brennan (International)Centres
Cette étude est fermée
Responsable du centre
Pr Isabelle PELLIER
Service d’Oncologie Pédiatrique
Tél. : 02 41 35 38 63 Fax : 02 41 35 52 91
Assistantes sociales
Célia Fillon
Tél : 02 41 35 49 85
CeFillon@chu-angers.fr
Attaché(e) de Recherche Clinique
Marianne ROUMY
02 41 35 63 85
marianne.roumy@chu-angers.fr
Responsable du centre
Dr Antoine Gourmel
Secrétariat :
Tél. : 03 22 08 76 44 Fax : 03 22 08 96 79
Assistantes sociales
Madame
Emilie Poillion
Poillion.Emilie@chu-amiens.fr
Attaché(e) de Recherche Clinique
Alicia PLAYE
03 22 08 76 49
playe.alicia@chu-amiens.fr
Responsable du centre
Pr Justyna KANOLD
Centre Régional de Cancérologie et de Thérapie Cellulaire Pédiatrique
Tél : 04 73 75 00 09
Assistantes sociales
Charlotte MORTIER
Tel : 04 73 75 03 00 (poste 61441) / Mail : cmortier@chu-clermontferrand.fr
Attaché(e) de Recherche Clinique
Aurélie CHAUSSET
Tel : 04 73 75 51 77 / Mail : achausset@chu-clermontferrand.fr
Responsable du centre
Dr Claire briandet
Service d’Oncologie Hématologie Pédiatrique
Tél : 03 80 29 34 14 / Mail : nadira.mareghnia@chu-dijon.fr
Assistantes sociales
Chloé ARNOULT
Tel : 03 80 29 33 09 / Mail : chloe.arnoult@chu-dijon.fr
Attaché(e) de Recherche Clinique
Frédérique DEBOMY
Tel : 03 80 29 50 78 / Mail : frederique.debomy@chu-dijon.fr
Responsable du centre
Dr Corinne Armari Alla
Tél : 04 76 76 69 95
Assistantes sociales
Valérie GOITRE
Tel : 04 76 76 79 39 / Mail : VGoitre@chu-grenoble.fr
Attaché(e) de Recherche Clinique
Sandrine BILLET
Tel : 04 76 76 65 61 / Mail : SBillet@chu-grenoble.fr
Responsable du centre
Dr Perrine MAREC-BERARD
Institut d'Hématologie et d'Oncologie Pédiatrique
Tél. : 04 78 78 26 42
Assistantes sociales
Maryline SEVE
Tel : 04 69 16 65 58 / Mail : maryline.seve@chu-lyon.fr
Attaché(e) de Recherche Clinique
Cécile GIRAUD
Tel : 04 69 16 65 61 / Mail : cecile.giraud@lyon.unicancer.fr
Responsable du centre
Dr Marie-Pierre CASTEX
Unité d'Hémato-oncologie Pédiatrique
Tel : 05 34 55 86 10
Assistantes sociales
Mélanie LAUTRE
Tel : 05 34 55 87 12 / Mail : lautre.m@chu-toulouse.fr
Pauline BOHLAY
Tel : 05 34 55 85 93 / Mail : bohlay.p@chu-toulouse.fr
Attaché(e) de Recherche Clinique
Gwennaëlle LE ROY
Tel : 05 67 77 13 94 / Mail : leroy.g@chu-toulouse.fr
Responsable du centre
Dr Julien Lejeune
Service d’Onco-Hématologie Pédiatrique
Tél : 02 47 47 47 51
Assistantes sociales
Ismeri LEBLANC
Tel : 02 34 38 94 48 / Mail : i.leblanc@chu-tours.fr
Attaché(e) de Recherche Clinique
Christine COLOMBAT
Tel : 02 47 47 47 47 poste 76793 / Mail : c.colombat@chu-tours.fr
Descriptif de l'étude
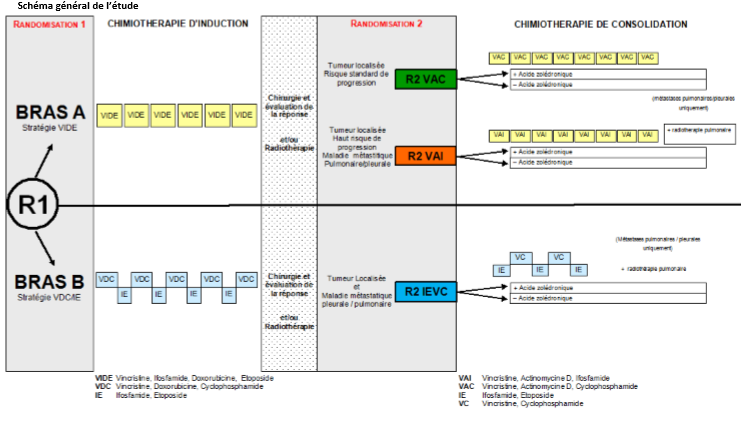
✱ Attention : Fermeture de la randomisation R1 (VIDE vs VDC/IE)
L’objectif lié à la randomisation de la chimiothérapie d’induction/consolidation (R1) est de comparer, d’un point de vue des résultats cliniques et de tolérance, la stratégie VIDE (induction par VIDE, consolidation par VAC, VAI ou BuMel en fonction du risque de progression des patients) à la stratégie VDC/IE (compression de l’induction par VDC/IE, consolidation par IE/VC ou BuMel en fonction du risque de progression des patients) comme traitement de première ligne chez les patients présentant une tumeur localisée ou métastatique pulmonaire ou pleurale.
L’objectif de la randomisation attribuant ou non de l’acide zolédronique (R2) est de déterminer dans quelle mesure l’ajout de ce médicament à la chimiothérapie de consolidation attribuée lors de la randomisation R1 est associé à une amélioration des résultats cliniques chez les patients présentant une tumeur de la famille des sarcomes d’Ewing, localisée ou métastatique au niveau pulmonaire ou pleurale.
Critères d'inclusion
- Tumeur de la famille du sarcome d’EWING de l’os et du tissu mou histologiquement confirmée
- Toute tumeur de la famille du sarcome d’EWING de l’os et du tissu mou histologiquement et génétiquement confirmée, ou sarcome à cellules rondes « Ewing-like » sans réarrangement EWSR1,
- Patient > 2 ans et < 50 ans à la date de la 1ère randomisation (à partir du jour du second anniversaire et jusqu’à 49 ans et 364 jours),
- 1ère randomisation ≤ 45 jours après diagnostic (lors d’une biopsie ou de la chirurgie),
- Patient considéré médicalement apte à recevoir l’un ou l’autre des traitements attribués lors de la randomisation R1,
- Pas de traitement antérieur de la tumeur de la famille du sarcome d’Ewing autre que la chirurgie,
- Pour les femmes en âge de procréer, test de grossesse négatif et documenté,
- Patient acceptant l’utilisation d’une contraception efficace pendant toute la durée du traitement et pendant 12 mois après la fin de celui-ci pour les femmes en âge de procréer et 6 mois après la fin du traitement pour les hommes,
- Signature du consentement éclairé par le patient et/ou par les représentants légaux pour les patients mineurs.
Critères de non inclusion
Randomisation R1 :
- Maladie métastatique extra pulmonaire ou pleurale
- Contre-indication à l’un des médicaments proposés dans l’un ou l’autre des bras de la randomisation R1,
- Deuxième cancer,
- Femme enceinte ou allaitante,
- Suivi du patient impossible pour des raisons sociales, géographiques ou psychologiques.
Randomisation R2 :
- Antécédents de chirurgie dentaire (extraction ou chirurgie de la mâchoire) dans les 6 mois précédant la première administration d’acide zolédronique ou chirurgie dentaire prévue au cours de la période de traitement ou dans les 6 mois après la fin du traitement,
- Antécédent de fracture de la mâchoire,
- Tumeur de la famille des sarcomes d’Ewing au niveau de la maxillaire ou mandibulaire,
- Progression de la tumeur primaire ou apparition de nouvelles lésions au cours du traitement d’induction