Ouvrir la version "Familles" de cette fiche
| Pathologie | Neuroblastome réfractaire ou en rechute | Statut de l'essai | Clos |
| Type de l’étude | Interventionnelle | Phase | II |
| Age | De 1 an à 21 ans | Randomisation | OUI |
| Type du traitement | Traitement exclusif (Chimiothérapie, Thérapie ciblée) | Nombre d'inclusions attendues en France | 60 |
| Voie(s) d'administration du traitement | Perfusion intraveineuse et prise orale selon le médicament administré |
| Fin prévisionnelle des inclusions | 2021-02-17 | Date de la dernière mise à jour de la fiche | 2022-05-30 |
| Durée de participation | 6 à 12 mois de traitement.
Le suivi se fera jusqu’à 5 ans après l’inclusion
|
| N° EUDRACT | 2012-000072-42 | N° ClinicalTrials.gov | NCT02308527 |
Promoteur international
Université de BirminghamPromoteur Français
CHU de ToulouseInvestigateur principal
Dr Marion Gambart (France)
Dr Lucas Moreno (International)Centres
Cette étude est fermée
Responsable du centre
Dr Perrine MAREC-BERARD
Institut d'Hématologie et d'Oncologie Pédiatrique
Tél. : 04 78 78 26 42
Assistantes sociales
Maryline SEVE
Tel : 04 69 16 65 58 / Mail : maryline.seve@chu-lyon.fr
Attaché(e) de Recherche Clinique
Cécile GIRAUD
Tel : 04 69 16 65 61 / Mail : cecile.giraud@lyon.unicancer.fr
Responsable du centre
Dr Marie-Pierre CASTEX
Unité d'Hémato-oncologie Pédiatrique
Tel : 05 34 55 86 10
Assistantes sociales
Mélanie LAUTRE
Tel : 05 34 55 87 12 / Mail : lautre.m@chu-toulouse.fr
Pauline BOHLAY
Tel : 05 34 55 85 93 / Mail : bohlay.p@chu-toulouse.fr
Attaché(e) de Recherche Clinique
Gwennaëlle LE ROY
Tel : 05 67 77 13 94 / Mail : leroy.g@chu-toulouse.fr
Descriptif de l'étude
Attention : les bras IRINOTECAN ( Bras IT et BIT) sont fermés aux inclusions
Contexte :
Les cancers chez l’enfant sont des maladies orphelines, en particulier les neuroblastomes (130 nouveaux cas par an en France). Malgré des protocoles thérapeutiques très intensifs, la survie à 5 ans des enfants de plus de 1 an et porteurs d’un neuroblastome métastatique reste inférieure à 50%. Il est donc indispensable d’utiliser de nouveaux médicaments. Certains, comme le Témozolomide, l’Irinotecan, ou des médicaments limitant la vascularisation (apport de sang) de la tumeur comme le Bevacizumab (Avastin) ont déjà été testés seul ou en association et ont montré leur efficacité, mais aucune étude n’a comparé l’efficacité de ces différentes associations entre elles ou au traitement par monothérapie. L’objectif de cette étude est d’évaluer quelle combinaison est la plus efficace.
Ce protocole thérapeutique est une étude collaborative entre la Société Internationale d’Oncologie Pédiatrique Europe groupe Neuroblastomes (SIOPEN) et le consortium européen Innovative Therapies for Children with Cancer (ITCC).
Objectifs Principaux :
- Evaluer si l’ajout du Bevacizumab à la chimiothérapie de base (Témozolomide , Irinotecan-Témozolomide ou Topotecan-Temozolomide) démontre une efficacité chez les enfants porteurs d’un neuroblastome réfractaire ou en rechute.
- Evaluer si l’ajout de l’Irinotecan au Témozolomide augmente l’activité de cette chimiothérapie chez les enfants porteurs d’un neuroblastome réfractaire ou en rechute.
- Evaluer si l’ajout de Topotecan au Témozolomide augmente l’activité de cette chimiothérapie.
Objectifs Secondaires :
- Evaluer la toxicité de ces associations.
Objectifs Tertiaires :
- Observer les modifications des biomarqueurs de l’angiogenèse en RMN fonctionnelle.
- Etudier le rôle des niveaux des ARNm circulants de la Tyrosine hydroxylase (TH), l’homéobox 2b (PHOX2B) et la double cortine (DCX) et leurs signification pronostique en situation de rechute.
- Evaluer le rôle du profil moléculaire tumoral dans le sang et le tissu tumoral archivé comme biomarqueur pronostique et prédictif.
Critère de jugement principal :
Meilleure réponse tumorale (RC, TBRP, RP) quelle qu’en soit le moment pendant les 6 mois de traitement.
Déroulement de l’essai :
BEACON est un essai de phase II, randomisé, en ouvert, multicentrique international comportant 6 bras :
- Témozolomide seul (Groupe T)
- Témozolomide + Bevacizumab (Groupe BT)
- Témozolomide + Irinotecan (Groupe IT)
- Témozolomide + Bevacimuzab + Irinotecan (Groupe BIT)
- Temozolomide + Topotecan (Groupe TTo)
- Temozolomide + Topotecan + Bevacizumab (Groupe BTTo)
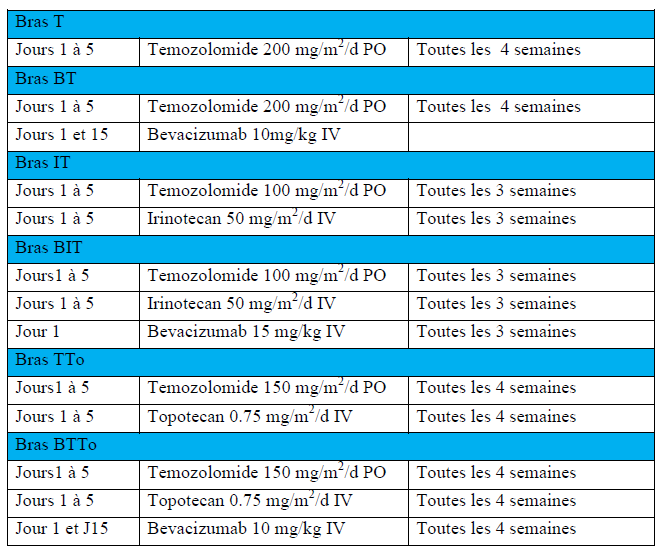
A compter du 01/07/2018, les bras BIT et IT seront fermés aux inclusions car le nombre de patients à inclure pour répondre à la question (Evaluer si l’ajout de l’Irinotecan au Témozolomide augmente l’activité de cette chimiothérapie chez les enfants porteurs d’un neuroblastome réfractaire ou en rechute.) sera atteint
Critères d'inclusion
Critères liés à la maladie :
- Neuroblastome histologiquement prouvé conformément à la définition de l’International Neuroblastoma Staging System (INSS) définition au diagnostic
- Neuroblastome en rechute ou réfractaire :
- Rechute : toute rechute ou progression d’un neuroblastome haut risque
- Refractaire : absence de réponse à un traitement de première ligne empêchant le patient d’accéder à un traitement de consolidation (par exemple CHD)
- Cibles mesurables sur l’imagerie selon les critères RECIST, ou maladie évaluable (fixation sur la scintigraphie à la MIBG avec ou sans biopsie ostéo-médullaires ou myélogrammes positifs). Les patients n’ayant qu’une maladie médullaire (myélogramme et/ou biopsie ostéo-médullaire) ne sont pas éligible dans l’étude
Critères généraux :
- Age entre 1 et 21 ans
- Consentement signé par le patient, les parents ou tuteurs légaux.
- Etre affilié à un régime de sécurité sociale ou bénéficier d’un tel régime
Conditions physiologiques :
- Score de Lansky ≥ 50% ou Karnofsky ≥ 50% ou ECOG ≤ 3
(Les patients paraplégiques, capable de se tenir assis seuls dans leur fauteuil roulant, seront considérés comme ambulatoires dans leur index de performance)
- Espérance de vie ≥12 semaines
- Hématologie (dans les 72 heures avant la randomisation) :
- Pas d’envahissement médullaire :
- Plaquettes ≥75 x 109/L (pas de support plaquettaire dans les 72h)
- Polynucléaires neutrophiles ≥ 0.75 x109/L (pas de support G-CSF dans les 72h),
- Hémoglobine≥ 7.5g/dL (transfusion autorisée)
- Envahissement médullaire :
- Plaquettes ≥ 50 x109/L, (pas de support plaquettaire dans les 72h)
- Polynucléaires neutrophiles ≥ 0.5 x 109/L (pas de support G-CSF dans les 72h),
- Hémoglobine≥ 7.5g/dL (transfusion autorisée)
- Fonction rénale (dans les 7 jours avant la randomisation) :
- Absence de protéinurie cliniquement significative (bandelette sur urines fraîches du matin <2+). Quand la bandelette urinaire indique une protéinurie ≥2+, le ratio protéine/créatinine (Pr/Cr) doit être <0.5 ou la protéinurie des 24 h <0.5g
- Créatininémie ≤ 1.5 la limite supérieure en fonction de l’âge ; en cas de chiffre plus élevé, mesurer la clairance à l’EDTA qui doit être ≥ 60 ml/min/1.73 m2
- Fonctions hépatiques (dans les 72 heures avant la randomisation): AST et ALT ≤ 2.5 la limite supérieure, bilirubine totale ≤1.5 la limite supérieure. En présence de métastases hépatiques, AST and ALT ≤ 5 la limite supérieure et bilirubine ≤ 2.5 la limite supérieure
- Fonction cardiaque, fraction de raccourcissement ≥29% sur l’échocardiographie, dans les 4 semaines avant la randomisation ou dans les 12 semaines si le patient n’a pas reçu d’anthracyclines ou de drogues cardiotoxiques
- Coagulation : Les patients, non traités par anti-coagulants doivent avoir un INR≤1.5 et un TP/TCA ≤1.5 à la limite supérieure en fonction de l’âge. Les anticoagulants sont permis tant que les INR et TP/TCA sont dans les normes biologiques de l’institution et le patient doit être sous une dose stage d’anti-coagulants dans les deux semaines précédant l’inclusion. Tension artérielle sous le 95è percentile en fonction de l’âge et du sexe. L’utilisation d’antihypertenseurs est autorisée
- Test de grossesse négatif chez toute adolescente pubère dans les 72h précédant son inclusion dans l'essai
- Accord du patient pour utiliser une contraception efficace et adaptée, soit avec un taux d'échec de moins de 1% par an, (par exemple, les implants, les produits injectables combinés aux contraceptifs oraux, un dispositif intra-utérin (DIU), l'abstinence sexuelle ou un partenaire vasectomisé) qui devra être poursuivie pendant 6 mois après la fin du traitement pour tout adolescent pubère
Critères de non inclusion
- Traitement préalable avec du Bevacizumab
- Traitement préalable avec du Témozolomide, Irinotecan ou l’association des deux
- Antécédents d’épisode thrombotique sévère
- Episode thrombotique en cours
- Patient présentant une hypersensibilité à un des composants des médicaments, produis ovariens d’hamster chinois, anticorps recombinants ou à la Dacarbazine
- Patient ayant eu (à la date de la randomisation) :
- Myélogramme et/ou biopsie ostéo-médullaire dans les 48 heures précédentes
- Pose d’une voie centrale dans les 48 heures précédentes
- Chirurgie majeure dans les 4 semaines précédentes
- Biopsie à l’aiguille dans la semaine précédente
- Chimiothérapie dans les deux semaines précédentes
- Radiothérapie cranio spinale ou MIBG thérapeutique dans les 6 semaines précédentes et radiothérapie du lit tumoral dans les 2 semaines
- Chimiothérapie à haute dose suivie de réinjection de cellules souches hématopoïétiques dans les huit semaines précédentes
- Allogreffe de cellules souches hématopoïétiques dans les trois mois précédents
- Traitement expérimental dans les deux semaines ou dans les 5 demi-vies précédentes (si cette date est postérieure)
- Métastases hémorragiques (Les Patients ayant des métastases du système nerveux central peuvent être inclus tant que les métastases ne saignent pas)
- Envahissement de gros vaisseaux
- Patient ayant récemment présenté une hémorragie pulmonaire/hémoptysie dans les 6 mois avant l’inclusion
- Diathèse hémorragique héréditaire ou coagulopathie significative avec risque de saignement
- Antécédent de fistule abdominale, perforation gastro-intestinale, abcès intra-abdominal ou saignement gastro-intestinal actif dans les six mois précédents
- Patient présentant une maladie inflammatoire chronique de l’intestin et/ou avec une occlusion intestinale
- Patient présentant une intolérance au galactose, un déficit en lactase de Lapp ou un syndrome de Malabsorption du glucose et du galactose ainsi que ceux présentant une intolérance au fructose
- Toute situation médicale mettant le patient à risque de présenter des complications liées au traitement
- Inducteurs enzymatiques anticonvulsifs dans les 72h avant l’inclusion
- Toute condition médicale comportant un risque supplémentaire